近日,中国科学院武汉物理数学研究所唐淳研究员课题组及合作者在泛素链识别靶蛋白的分子机制研究中有了重大发现,相关成果发表在elife上。
泛素是一种广泛存在于真核细胞内的信号蛋白,泛素化修饰是生物体内最普遍的翻译后修饰之一,多个泛素通过不同方式的共价连接形成的泛素链在溶液中采取不同的构象识别各自的靶蛋白,从而在细胞内分别扮演着不同的角色。其中第63位赖氨酸连接的泛素链主要参与DNA的损伤修复、多泡体介导的蛋白质分选、NF-κB信号通路、氧化应激等生物学过程。之前的许多研究已经表明这种泛素链在溶液中只存在开放态,与某些靶蛋白结合后才以闭合态形式存在。闭合态是靶蛋白诱导而发生构象变化导致,还是一开始就存在,对于第63位赖氨酸连接的泛素链识别靶蛋白背后的分子机制一直不清楚。
核磁共振是研究生物大分子在溶液中构象动态变化的一种强有力手段。唐淳研究员及合作者采用顺磁弛豫增强(PRE)的方法并通过结构计算发现第63位赖氨酸连接的泛素链在溶液中存在很大比例的闭合态构象,对闭合态构象进一步分析发现它们至少可分为两类,分别可以与不同的靶蛋白结合。这项研究为这一泛素链在溶液中存在闭合态提供了直接的实验证据,并首次在原子水平描述了各种闭合态构象的结构信息,解释了泛素链与靶蛋白识别的分子机制。为进一步研究揭示其他种类的泛素链是否也通过构象选择的机制识别相应的的靶蛋白打下基础。
该工作得到了科技部、国家自然科学基金委,以及美国霍华德·休斯医学研究所(HHMI)基金的支持。
文章链接
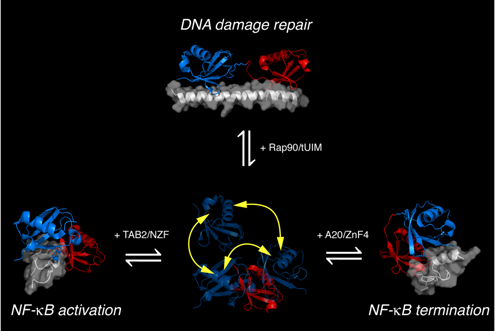
K63-diUb2在未结合靶蛋白时在溶液中存在30%的open态和70%的close态,并通过构象选择机制识别各自的靶蛋白,其中Rap90/tUIM结合open态di-Ub2参与DNA损伤修复;TAB2/NZF与A20/ZnF4结合不同的close态分别参与NF-κB信号通路的激活与终止。
附注:
elife简介:由美国、英国、德国的三大科学基金资助机构(Howard Hughes Medical Institute, the Max Planck Society, and the Wellcome Trust)创办的开放性学术期刊,美国科学院院士、2013年诺贝尔生理奖获得者兰迪·谢克曼担任主编,此刊聚集了包括王晓东在内的国际一流生物学家做主编、编委,旨在发表CNS水平的论文.


